ਬੋਏਲ ਦਾ ਕਾਨੂੰਨ
ਬੋਏਲ ਦਾ ਕਾਨੂੰਨ(ਕਈ ਵਾਰ ਬੋਏਲ-ਮਰੀਓਟ ਕਾਨੂੰਨ, ਜਾਂ ਮਰੀਓਟ ਦੇ ਕਾਨੂੰਨ[1] ਵਜੋਂ ਜਾਣਿਆ ਜਾਂਦਾ ਹੈ) ਇੱਕ ਪ੍ਰਯੋਗਿਕ ਗੈਸ ਕਾਨੂੰਨ ਹੈ ਜੋ ਇਹ ਦੱਸਦਾ ਹੈ ਕਿ ਕਿਵੇਂ ਗੈਸ ਦਾ ਦਬਾਅ, ਕੰਨਟੇਨਰ ਘਟਣ ਦੀ ਮਾਤਰਾ ਨਾਲ ਵਧਦਾ ਹੈ। ਬੌਲੇ ਦੇ ਕਾਨੂੰਨ ਦਾ ਇੱਕ ਆਧੁਨਿਕ ਬਿਆਨ:
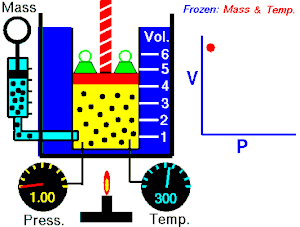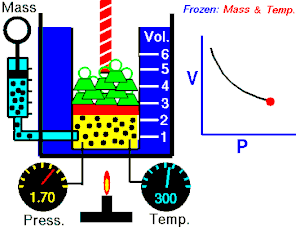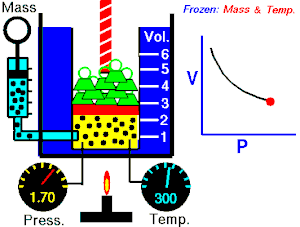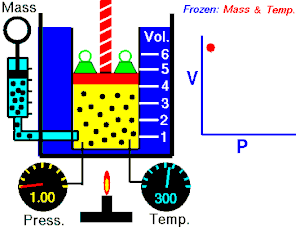
ਇੱਕ ਆਦਰਸ਼ਕ ਗੈਸ ਦੇ ਦਿੱਤੇ ਗਏ ਪੁੰਜ ਦੁਆਰਾ ਲਗਾਇਆ ਜਾ ਰਿਹਾ ਪੂਰਨ ਦਬਾਅ, ਵਾਲੀਅਮ ਦਾ ਉਲਟ ਅਨੁਪਾਤ ਹੁੰਦਾ ਹੈ, ਜੇਕਰ ਇੱਕ ਬੰਦ ਸਿਸਟਮ ਵਿੱਚ ਤਾਪਮਾਨ ਅਤੇ ਗੈਸ ਦੀ ਮਾਤਰਾ ਵਿੱਚ ਕੋਈ ਬਦਲਾਅ ਨਹੀਂ ਹੁੰਦਾ।[2][3]
ਮੈਥੇਮੈਟਿਕਲ ਤੌਰ 'ਤੇ, ਬੋਏਲ ਦੇ ਕਾਨੂੰਨ ਨੂੰ ਇਸ ਤਰਾਂ ਦਰਸਾਇਆ ਜਾ ਸਕਦਾ ਹੈ:
ਜਾ
ਜਿੱਥੇ P ਗੈਸ ਦਾ ਦਬਾਅ ਹੈ, V ਗੈਸ ਦਾ ਵਾਲੀਅਮ ਹੈ, ਅਤੇ K ਨਿਰੰਤਰ ਹੈ।
ਇਹ ਸਮੀਕਰਨ ਦੱਸਦਾ ਹੈ ਕਿ ਦਬਾਅ ਅਤੇ ਵਾਲੀਅਮ ਦਾ ਉਤਪਾਦਨ, ਇਕੋ ਜਿਹੇ ਗੈਸਾਂ ਲਈ ਇੱਕ ਸਥਿਰ ਹੈ ਜਦੋਂ ਤੱਕ ਤਾਪਮਾਨ ਲਗਾਤਾਰ ਹੁੰਦਾ ਹੈ। ਇੱਕੋ ਪਦਾਰਥ ਦੀ ਦੋ ਵੱਖ ਵੱਖ ਸੈੱਟਾਂ ਦੇ ਤਹਿਤ ਤੁਲਨਾ ਕਰਨ ਲਈ, ਕਾਨੂੰਨ ਨੂੰ ਇਸ ਉਪਯੋਗੀ ਤਰੀਕੇ ਨਾਲ ਦਰਸਾਇਆ ਜਾ ਸਕਦਾ ਹੈ:
ਇਹ ਸਮੀਕਰਨ ਦਰਸਾਉਂਦੀ ਹੈ, ਕਿ ਜਦੋਂ ਵਾਲੀਅਮ ਵਧਦਾ ਹੈ, ਗੈਸ ਦਾ ਦਬਾਅ ਘੱਟ ਜਾਂਦਾ ਹੈ। ਇਸੇ ਤਰ੍ਹਾਂ, ਜਿਵੇਂ ਕਿ ਵਾਲੀਅਮ ਘੱਟਦਾ ਹੈ, ਗੈਸ ਦਾ ਦਬਾਅ ਵਧਦਾ ਹੈ। ਇਹ ਕਾਨੂੰਨ ਕੈਮਿਸਟ ਅਤੇ ਭੌਤਿਕ ਵਿਗਿਆਨੀ ਰੌਬਰਟ ਬੋਇਲ ਦੇ ਨਾਂ ਤੇ ਰੱਖਿਆ ਗਿਆ ਸੀ, ਜਿਸਨੇ 1662 ਵਿੱਚ ਮੂਲ ਕਾਨੂੰਨ ਨੂੰ ਪ੍ਰਕਾਸ਼ਿਤ ਕੀਤਾ ਸੀ।[4]
ਹਵਾਲੇ
ਸੋਧੋ- ↑ Draper, John William (1861). A Textbook on chemistry. p. 46.
- ↑ Levine, Ira. N (1978). "Physical Chemistry" University of Brooklyn: McGraw-Hill
- ↑ Levine, Ira. N. (1978), p. 12 gives the original definition.
- ↑ In 1662, he published a second edition of the 1660 book New Experiments Physico-Mechanical, Touching the Spring of the Air, and its Effects with an addendum Whereunto is Added a Defence of the Authors Explication of the Experiments, Against the Obiections of Franciscus Linus and Thomas Hobbes; see J Appl Physiol 98: 31–39, 2005. (Jap.physiology.org Online Archived 2010-10-27 at the Wayback Machine..)


