ਬੋਹਰ ਮਾਡਲ
1915 ਵਿੱਚ ਨੀਲ ਬੋਹਰ ਦੁਆਰਾ ਐਟਮ ਦੇ ਮਾਡਲ ਦੀ ਤਜਵੀਜ਼ ਕੀਤੀ ਗਈ ਸੀ। ਇਹ ਮਾਡਲ ਉਦੋਂ ਹੋਂਦ ਵਿੱਚ ਆਇਆ ਜਦੋਂ ਰਦਰਫੋਰਡ ਦੇ ਅਟਾਮਿਕ ਮਾਡਲ ਵਿੱਚ ਸੋਧ ਕੀਤੀ ਗਈ। ਰਦਰਫੋਰਡ ਦੇ ਮਾਡਲ ਨੇ ਐਟਮ ਦਾ ਪ੍ਰਮਾਣੂ ਮਾਡਲ ਪੇਸ਼ ਕੀਤਾ ਸੀ, ਜਿਸ ਵਿੱਚ ਉਸ ਨੇ ਸਮਝਾਇਆ ਕਿ ਨਿਊਕਲੀਅਸ ਨੈਗੇਟਿਵ ਚਾਰਜ ਇਲੈਕਟ੍ਰੋਨਾਂ ਨਾਲ ਘਿਰਿਆ ਹੋਇਆ ਹੈ। ਬੋਹਰ ਨੇ ਇਹ ਪਰਮਾਣੂ ਢਾਂਚੇ ਨੂੰ ਸੋਧ ਕੇ ਕਿਹਾ ਕਿ ਇਲੈਕਟ੍ਰੌਨ ਇੱਕ ਫਿਕਸ ਸ਼ੈੱਲਾਂ ਵਿੱਚ ਘੁਮੰਦੇ ਹਨ ਅਤੇ ਹੋਰ ਕਿਤੇ ਵੀ ਐਟਮ ਵਿੱਚ ਵਿਚਾਲੇ ਨਹੀਂ। ਅਤੇ ਉਸ ਨੇ ਇਹ ਵੀ ਸਮਝਾਇਆ ਕਿ ਹਰ ਇੱਕ ਸ਼ੈਲ ਕੋਲ ਇੱਕ ਨਿਸ਼ਚਿਤ ਊਰਜਾ ਦਾ ਪੱਧਰ ਹੈ। ਰਦਰਫ਼ਰਡ ਨੇ ਮੂਲ ਰੂਪ 'ਤੇ ਇੱਕ ਐਟਮ ਦੇ ਨਿਊਕਲੀਅਸ ਦੀ ਵਿਆਖਿਆ ਕੀਤੀ ਅਤੇ ਬੋਹਰ ਨੇ ਉਸ ਮਾਡਲ ਨੂੰ ਇਲੈਕਟ੍ਰੋਨ ਅਤੇ ਉਹਨਾਂ ਦੇ ਊਰਜਾ ਦੇ ਪੱਧਰਾਂ ਵਿੱਚ ਬਦਲਿਆ।
ਬੋਹਰ ਮਾਡਲ ਦੀਆਂ ਮਨੌਤੀਆਂ
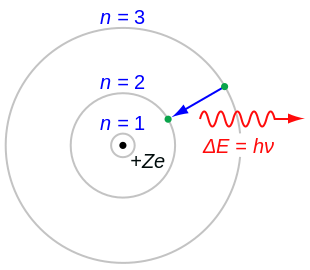
ਸੋਧੋ- ਇੱਕ ਐਟਮ ਵਿੱਚ, ਇੱਕ ਇਲੈਕਟਰੌਨ ਇੱਕ ਪਰਿਭਾਸ਼ਿਤ ਚੱਕਰੀ ਰਸਤੇ (ਸ਼ੈਲ) ਵਿੱਚ ਸਕਾਰਾਤਮਕ ਚਾਰਜ ਵਾਲੇ ਨਿਊਕਲੀਅਸ ਦੇ ਆਲੇ ਦੁਆਲੇ ਘੁਮਦਾ ਹੈ।
- ਹਰ ਇੱਕ ਚੱਕਰੀ ਰਸਤੇ ਜਾਂ ਸ਼ੈੱਲ ਦੀ ਇੱਕ ਨਿਸ਼ਚਿਤ ਊਰਜਾ ਹੁੰਦੀ ਹੈ ਅਤੇ ਇਹ ਗੋਲ ਸ਼ੈੱਲ, ਆਰਬਿਟਲ ਸ਼ੈੱਲ ਵਜੋਂ ਜਾਣੇ ਜਾਂਦੇ ਹਨ।
- ਊਰਜਾ ਦਾ ਪੱਧਰ ਇੱਕ ਪੂਰਨ ਅੰਕ ਵਜੋਂ ਦਰਸਾਇਆ ਜਾਂਦਾ ਹੈ (n = 1, 2, 3 ...) ਜਿਸਨੂੰ ਕੁਆਂਟਮ ਨੰਬਰ ਕਿਹਾ ਜਾਂਦਾ ਹੈ। ਕੁਆਂਟਮ ਨੰਬਰ ਦੀ ਇਹ ਹੱਦ ਨਿਊਕਲੀਅਸ ਸਾਈਡ ਤੋਂ ਸ਼ੁਰੂ ਹੁੰਦੀ ਹੈ ਅਤੇ n=1 ਕੋਲ ਸਭ ਤੋਂ ਘੱਟ ਊਰਜਾ ਦਾ ਪੱਧਰ ਹੁੰਦਾ ਹੈ। ਇਸ ਤੋਂ ਇਲਾਵਾ n = 1, 2, 3, 4 ... ਨੂੰ ਕੇ, ਐਲ, ਐਮ, ਐਨ ... ਦੇ ਰੂਪ ਵਿੱਚ ਵੀ ਲਿਖਿਆ ਜਾ ਸਕਦਾ ਹੈ। ਅਤੇ ਜਦੋਂ ਇੱਕ ਇਲੈਕਟ੍ਰੋਨ ਸਭ ਤੋਂ ਘੱਟ ਊਰਜਾ ਦੇ ਪੱਧਰ ਨੂੰ ਪ੍ਰਾਪਤ ਕਰਦਾ ਹੈ ਤਾਂ ਇਸਨੂੰ ਗ੍ਰਾਉਂਡ ਸਟੇਟ ਵਿੱਚ ਕਿਹਾ ਜਾਂਦਾ ਹੈ।
- ਲੋੜੀਂਦੀ ਊਰਜਾ ਪ੍ਰਾਪਤ ਕਰਕੇ ਇੱਕ ਊਰਜਾ ਪੱਧਰ ਤੋਂ ਉੱਚ ਊਰਜਾ ਪੱਧਰ ਤੱਕ ਇੱਕ ਇਲੈਕਟ੍ਰੌਨ ਜਾ ਸਕਦਾ ਹੈ ਅਤੇ ਊਰਜਾ ਦੀ ਨਿਕਾਸੀ ਕਰਕੇ ਉਹ ਫਿਰ ਤੋਂ ਗ੍ਰਾਉਂਡ ਸਟੇਟ ਵਿੱਚ ਆ ਸਕਦਾ ਹੈ।
ਹਵਾਲੇ
ਸੋਧੋ- ↑ Lakhtakia, Akhlesh; ਸਾਲਪੀਟਰ, ਏਡਵਿਨ ਈ (1996). "ਹਾਈਡ੍ਰੋਜਨ ਦਾ ਮਾਡਲ". ਅਮਰੀਕੀ ਜਰਨਲ ਆਫ਼ ਫਿਜ਼ਿਕਸ. 65 (9). ਵਰਲਡ ਸਾਇਨਟੀਫ਼ਿਕ: 933. Bibcode:1997AmJPh..65..933S. doi:10.1119/1.18691. ISBN 981-02-2302-1.