ਸ਼ੀਲਡਿੰਗ ਪ੍ਰਭਾਵ
ਸ਼ੀਲਡਿੰਗ ਪ੍ਰਭਾਵ, ਇੱਕ ਤੋਂ ਵੱਧ ਇਲੈਕਟ੍ਰੌਨ ਸ਼ੈਲ ਵਾਲੇ ਕਿਸੇ ਵੀ ਐਟਮ ਵਿੱਚ ਇਲੈਕਟ੍ਰੋਨ ਅਤੇ ਨਿਊਕਲੀਅਸ ਦੇ ਵਿਚਕਾਰ ਖਿੱਚ ਦਾ ਵਰਣਨ ਕਰਦਾ ਹੈ। ਸ਼ੀਲਡਿੰਗ ਪ੍ਰਭਾਵ ਇਲੈਕਟ੍ਰਾਨ ਕਲਾਉਡ ਉੱਤੇ ਪ੍ਰਭਾਵਸ਼ਾਲੀ ਪਰਮਾਣੂ ਪ੍ਰਭਾਵ ਵਿੱਚ ਕਮੀ ਦੇ ਰੂਪ ਵਿੱਚ ਵੀ ਪਰਿਭਾਸ਼ਿਤ ਕੀਤਾ ਜਾ ਸਕਦਾ ਹੈ, ਨਿਊਕਲੀਅਸ ਤੇ ਇਲੈਕਟ੍ਰੌਨਾਂ ਦੇ ਆਕਰਸ਼ਣ ਵਿੱਚ ਇੱਕ ਫਰਕ ਦੇ ਕਾਰਨ। ਇਸ ਨੂੰ ਸਕ੍ਰੀਨਿੰਗ ਪ੍ਰਭਾਵ ਜਾਂ ਪ੍ਰਮਾਣੂ ਪ੍ਰਭਾਵ ਵਜੋਂ ਵੀ ਜਾਣਿਆ ਜਾਂਦਾ ਹੈ।
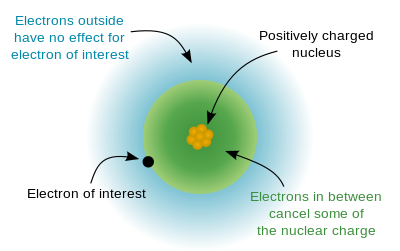
ਕਾਰਨ
ਸੋਧੋਪੀਰੀਓਡਿਕ ਟੇਬਲ ਦੇ ਗਰੁੱਪ 1ਏ (ਜਿਹਨਾਂ ਕੋਲ ਸਿਰਫ਼ ਇੱਕ ਹੀ ਵਾਲੈਂਸ ਇਲੈਕਟ੍ਰੋਨ ਹਨ।) ਵਿੱਚ ਹਾਈਡਰੋਜਨ ਜਾਂ ਕੋਈ ਹੋਰ ਐਟਮ ਵਿੱਚ, ਇਲੈਕਟ੍ਰੌਨ ਤੇ ਫੋਰਸ ਨਿਊਕਲੀਅਸ ਤੋਂ ਇਲੈਕਟ੍ਰੋਮੈਗਨੈਟਿਕ ਖਿੱਚ ਦੇ ਬਰਾਬਰ ਹੈ। ਹਾਲਾਂਕਿ, ਜਦੋਂ ਹੋਰ ਇਲੈਕਟ੍ਰੌਨ ਸ਼ਾਮਲ ਹੁੰਦੇ ਹਨ, ਤਾਂ ਹਰੇਕ ਇਲੈਕਟ੍ਰੋਨ (ਐਨ-ਸ਼ੈਲ ਵਿਚ) ਨਾ ਕੇਵਲ ਸਕਾਰਾਤਮਕ ਨਿਊਕਲੀਅਸ ਦੀ ਇਲੈਕਟ੍ਰੋਮੈਗਨੈਟਿਕ ਖਿੱਚ ਦਾ ਅਨੁਭਵ ਕਰਦਾ ਹੈ, ਬਲਕਿ 1 ਤੋਂ n ਤੱਕ ਦੇ ਹੋਰ ਇਲੈਕਟ੍ਰੌਨ ਦੀ ਰੀਪਲਸ਼ਨ ਫੋਰਸ ਦੇ ਪ੍ਰਭਾਵ ਹੇਠ ਵੀ ਹੁੰਦਾ ਹੈ। ਬਾਹਰੀ ਸ਼ੈੱਲਾਂ ਵਾਲੇ ਇਲੈਕਟ੍ਰੋਨਾਂ 'ਤੇ ਨੈਟ ਫੋਰਸ ਬਹੁਤ ਛੋਟਾ ਬਣ ਜਾਂਦਾ ਹੈ; ਇਸ ਲਈ, ਇਹ ਇਲੈਕਟ੍ਰੌਨ ਨਿਊਕਲੀਅਸ ਦੇ ਨਜ਼ਦੀਕ ਨਾ ਹੋਣ ਕਰਕੇ ਨਿਊਕਲੀਅਸ ਨਾਲ ਜ਼ੋਰਦਾਰ ਬੰਧਨ ਨਹੀਂ ਬਣਾ ਪਾਉਂਦੇ। ਇਸ ਵਰਤਾਰੇ ਨੂੰ ਆਮ ਤੌਰ 'ਤੇ ਆਰਬੀਟਲ ਪੈਨੀਟ੍ਰੇਸ਼ਨ ਪ੍ਰਭਾਵ ਵਜੋਂ ਦਰਸਾਇਆ ਜਾਂਦਾ ਹੈ। ਸ਼ੀਲਡਿੰਗ ਥਿਊਰੀ ਵੀ ਇਸ ਸਪਸ਼ਟੀਕਰਨ ਵਿੱਚ ਯੋਗਦਾਨ ਪਾਉਂਦੀ ਹੈ ਕਿ ਕਿਵੇਂ ਵੈਲੈਂਸ-ਸ਼ੈਲ ਇਲੈਕਟ੍ਰੌਨਾਂ ਨੂੰ ਐਟਮ ਤੋਂ ਆਸਾਨੀ ਨਾਲ ਹਟਾਇਆ ਜਾਂਦਾ ਹੈ।
ਕੁਆਂਟਮ ਮਕੈਨਿਕਸ ਤੋਂ ਪ੍ਰਭਾਵ ਦੇ ਕਾਰਨ ਸ਼ੀਲਡਿੰਗ ਪ੍ਰਭਾਵ ਦਾ ਆਕਾਰ ਸਹੀ ਢੰਗ ਨਾਲ ਕੱਢਣਾ ਮੁਸ਼ਕਲ ਹੁੰਦਾ ਹੈ। ਇੱਕ ਅੰਦਾਜ਼ੇ ਵਜੋਂ, ਅਸੀਂ ਹੇਠ ਲਿਖੇ ਅਨੁਸਾਰ ਹਰੇਕ ਇਲੈਕਟ੍ਰੋਨ 'ਤੇ ਪ੍ਰਭਾਵਸ਼ਾਲੀ ਪਰਮਾਣੂ ਪ੍ਰਭਾਵ ਦਾ ਅੰਦਾਜ਼ਾ ਲਗਾ ਸਕਦੇ ਹਾਂ:
ਜਿੱਥੇ ਕਿ Z ਨਿਊਕਲੀਅਸ ਵਿੱਚ ਪ੍ਰੋਟੋਨ ਦੀ ਗਿਣਤੀ ਹੈ ਅਤੇ ਨਿਊਕਲੀਅਸ ਅਤੇ ਇਲੈਕਟ੍ਰੋਨ ਦੇ ਵਿਚਕਾਰ ਇਲੈਕਟ੍ਰੋਨ ਦੀ ਔਸਤਨ ਗਿਣਤੀ ਹੈ। ਨੂੰ ਕੁਆਂਟਮ ਰਸਾਇਣ ਅਤੇ ਸਕਰੋਡਿੰਗਰ ਸਮੀਕਰਨ, ਜਾਂ ਸਲੈਟਰ ਦੇ ਅਨੁਭਵੀ ਫਾਰਮੂਲਿਆਂ ਦੀ ਵਰਤੋਂ ਕਰਕੇ ਲੱਭਿਆ ਜਾ ਸਕਦਾ ਹੈ।
ਰਦਰਫ਼ਰਡ ਬੈਕਸਕੇਟਰਿੰਗਸਪੈਕਟ੍ਰੋਸਕੋਪੀ ਵਿੱਚ ਇਲੈਕਟ੍ਰੋਨ ਸਕ੍ਰੀਨਿੰਗ ਦੇ ਕਾਰਨ ਸੋਧ ਕਾਰਨ ਆਇਨ ਅਤੇ ਵੱਡੇ ਦੂਰੀ ਤੇ ਟਾਰਗਟ ਨਿਊਕਲੀਅਸ ਦੇ ਵਿਚਕਾਰ ਕੋਲੋਬ ਰੀਪਲਸ਼ਨ ਨੂੰ ਬਦਲਦਾ ਹੈ।
ਇਹ ਵੀ ਵੇਖੋ
ਸੋਧੋਹਵਾਲੇ
ਸੋਧੋ- L. Brown, Theodore; H. Eugene LeMay Jr; Bruce E. Bursten; Julia R. Burdge (2003). Chemistry: The Central Science (8th ed.). US: Pearson Education. ISBN 0-13-061142-5. Archived from the original on 2011-07-24. Retrieved 2017-07-25.
{{cite book}}: Unknown parameter|dead-url=ignored (|url-status=suggested) (help) - Dan Thomas, Shielding in Atoms, [1] Archived 2018-02-20 at the Wayback Machine.
- Peter Atkins & Loretta Jones, Chemical principles: the quest for insight [Variation in shielding effect]